

在生命科学基础研究与体外检测领域,抗体是至关重要的特异性识别分子。作为科研试剂,单克隆抗体与多克隆抗体在分子结构、组成和来源上存在本质区别,这些差异直接决定了它们的理论特性与应用边界。
▌分子结构与组成的本质差异
◆ 分子均一性与化学组成
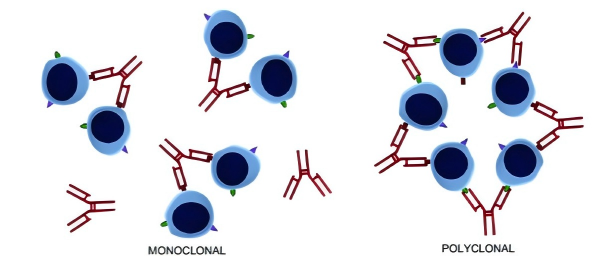
单克隆抗体是由一个单一的B淋巴细胞克隆所产生的高度均一的蛋白质分子群。所有抗体分子在氨基酸序列、三维空间结构以及抗原结合位点(互补决定区,CDR)上完全一致,属于化学组成单一的分子实体。这种均一性源于其由单一的基因重排事件所决定。
多克隆抗体则是由动物免疫后,多个不同的B淋巴细胞克隆共同产生的抗体混合物。该混合物中包含了一系列针对同一抗原不同表位的抗体分子,各抗体在轻重链的氨基酸序列、空间构象以及亲和力上均存在差异。因此,多克隆抗体在化学本质上是一种非均质的、多克隆的免疫球蛋白集合。
◆ 抗原识别表位的性质
单克隆抗体仅特异性识别目标抗原上的某一个特定的、单一的抗原表位。该表位可以是线性表位(由连续的氨基酸序列构成)或构象性表位(由空间上邻近但不连续的氨基酸残基构成)。
多克隆抗体能够识别目标抗原表面存在的多个不同的抗原表位。这包括线性与构象性表位的组合,从而实现对目标抗原的多位点覆盖。
▌产生原理与来源的对比
◆ 制备原理与细胞来源
单克隆抗体的制备基于杂交瘤技术。基本原理是将经抗原免疫的小鼠脾细胞(富含激活的B淋巴细胞)与具有无限增殖能力的骨髓瘤细胞进行融合。通过筛选和单克隆化,获得能够稳定分泌单一抗体的杂交瘤细胞株。该细胞株可作为永久且稳定的抗体生产源。
多克隆抗体的制备直接依赖于宿主动物的体液免疫反应。将纯化后的抗原免疫宿主动物(如兔、羊、马等),经过多次免疫后,采集富含目标抗体的血清。血清中的抗体是动物体内所有被该抗原激活的B细胞克隆分泌产物的总和,未经进一步的细胞克隆化筛选。
◆ 生产来源的稳定性与可重复性
单克隆抗体的来源是永生的杂交瘤细胞系。理论上,该细胞系可以在体外无限培养并持续分泌完全相同的抗体,因此能保证不同生产批次间产物的高度一致性和可重复性。
多克隆抗体的来源是活体动物。其产量和质量受动物个体免疫反应差异、年龄、健康状况及采血时间点等多种生物变量影响。即使使用相同的抗原和免疫流程,不同批次间抗体的组成谱和效价也存在不可避免的差异。
▌理论特性的衍生区别
基于上述分子结构与来源的差异,二者衍生出以下核心理论特性对比:
◆ 特异性与交叉反应性
单克隆抗体:因其针对单一表位,通常具有极高的特异性。理论上,它能精确区分目标蛋白与其他蛋白,甚至同一蛋白不同翻译后修饰状态或构象。然而,若该特定表位在非目标蛋白上同样存在,则可能发生交叉反应。
多克隆抗体:由于是识别多个表位的混合物,其对目标抗原的总体亲和力较高,但针对任一单个表位的特异性可能低于优质单抗。交叉反应的风险来自混合物中可能包含的、针对与非目标蛋白共享表位的抗体成分。
◆ 亲和力与结合特性
单克隆抗体:具有固定的、单一的亲和力常数(Kd),由其抗原结合位点的结构决定。每个抗体分子以相同的结合强度与表位结合。
多克隆抗体:其总结合力是混合物中所有抗体不同亲和力的综合体现,表现为一个平均亲和力或范围。混合物中通常包含高、中、低不同亲和力的抗体成分。
◆ 对抗原变异的稳健性
单克隆抗体:对抗原的微小变化极为敏感。若目标表位因基因突变、蛋白剪切或化学修饰而发生改变,可能导致结合能力完全丧失。
多克隆抗体:因其识别多个独立表位,具有更强的“缓冲”能力。即使抗原的个别表位发生改变或丢失,其他表位仍可被有效识别,因此在面对抗原变异时通常表现得更稳健。
◆ 功能性应用的潜在影响
从原理上分析,其分子差异直接影响其在特定技术中的应用倾向:
单克隆抗体:其均一性使其非常适合需要精确、定量和可重复结合的应用,也便于进行化学标记或功能化修饰。其在复杂样本中检测特定靶标变体方面具有理论优势。
多克隆抗体:其多位点结合的特性,使其在需要交联、沉淀或放大信号的应用中具有天然优势。例如,在免疫沉淀中,多个抗体从不同方位结合同一抗原,可形成更稳定的免疫复合物。
▌结论
从分子生物学与免疫学基础来看,单克隆抗体与多克隆抗体的区别,本质上是单一克隆均质分子与多克隆异质混合物的区别。这一根本差异,衍生出了二者在特异性、亲和力谱、稳健性及生产可重复性等一系列理论特性上的不同。理解这些基于分子结构与原理的核心差异,是科研人员根据特定实验的底层逻辑,在二者之间做出理性选择的理论基础。