

兔多克隆抗体作为生命科学研究的关键工具,因其高亲和力、良好特异性以及相对便捷的制备流程,在基础研究、药物开发和诊断试剂开发等领域发挥着重要作用。
▌兔多克隆抗体的生物学基础
兔免疫系统对外来抗原能产生强烈的体液免疫反应,这是制备高质量多克隆抗体的生物学基础。当抗原通过适当途径进入新西兰白兔等常用免疫动物体内后,会经过抗原呈递细胞的处理和呈递,激活B淋巴细胞。被激活的B细胞进一步分化为浆细胞,大量分泌针对抗原不同表位的特异性抗体,这些抗体混合在一起即构成多克隆抗体。
与单克隆抗体相比,兔多克隆抗体具有多个独特优势:首先,它们能识别抗原的多个表位,提高了检测的灵敏度;其次,免疫反应强烈,通常能获得较高效价的抗血清;再者,兔抗体与人蛋白的同源性较低,减少了交叉反应的可能性。此外,兔免疫系统对较小抗原表位(如短肽)也能产生良好反应,这为针对特定蛋白区域制备抗体提供了便利。
▌抗原设计与制备
抗原的质量直接决定最终抗体的特异性和效价。常用的抗原类型包括重组蛋白、合成多肽、全细胞提取物等。重组蛋白作为抗原时,需确保其正确的折叠构象和纯度;合成多肽则需根据目标蛋白的抗原性分析,选择亲水性、表面可及性较好的区域,通常长度为10-20个氨基酸。对于弱免疫原性的小分子物质(如小分子化合物、修饰基团等),需要将其偶联到载体蛋白(如KLH、BSA)上以增强免疫原性。
抗原制备过程中需要注意避免蛋白变性、降解,并确保内毒素水平控制在可接受范围内。对于多肽抗原,通常建议在C端或N端添加半胱氨酸残基,便于与载体蛋白偶联。抗原的纯度和浓度需经过严格测定,通常建议免疫用抗原纯度不低于90%。
▌动物免疫程序
免疫程序的设计对抗体质量有决定性影响。通常选择3-4月龄、体重2.0-2.5kg的健康新西兰白兔作为免疫动物,每组至少2-3只以应对个体差异。首次免疫通常使用完全弗氏佐剂与抗原乳化,随后加强免疫使用不完全弗氏佐剂。免疫途径多采用皮下多点注射,也可采用肌肉注射或皮内注射。
免疫时间间隔需科学安排:首次免疫后2-4周进行第一次加强免疫,之后每隔2-3周进行后续加强免疫。通常在第三次加强免疫后7-10天进行试采血,检测血清效价和特异性。达到理想效价后(通常ELISA效价不低于1:64,000),进行终末采血或定期采血。
▌抗血清采集与处理
当血清效价达到平台期时,即可进行大量采血。采血前需禁食12小时以减少血清脂质含量。常用的采血方法包括耳中央动脉穿刺、心脏穿刺和颈动脉插管术。其中颈动脉插管术可获得最大血量(可达体重的1.5-2%),但需在麻醉下由专业人员操作。
采集的全血在37℃孵育30-60分钟后,于4℃静置2-4小时或过夜,使其充分凝固。然后以2,000-3,000g离心15-20分钟,分离得到抗血清。抗血清需经过0.22μm滤膜过滤除菌,并添加0.02%叠氮化钠或0.01%硫柳汞作为防腐剂,分装后于-80℃长期保存。
▌抗体纯化与鉴定
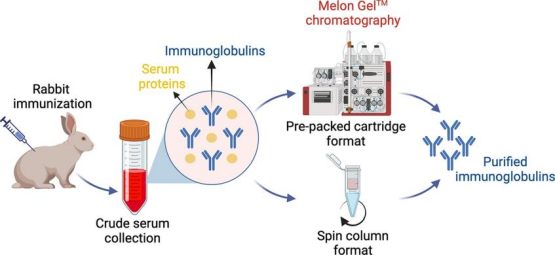
粗抗血清中含有大量非特异性免疫球蛋白和其他血清蛋白,需要通过纯化步骤获得特异性抗体。最常用的纯化方法是蛋白A或蛋白G亲和层析,它们能特异性地结合兔IgG的Fc区域。对于需要更高特异性的应用,可采用抗原亲和纯化,将抗原偶联到固相基质上,特异性捕获目标抗体。
纯化后的抗体需要进行全面的质量鉴定,包括:
1.浓度测定:通过紫外分光光度法(A280)或BCA法测定
2.纯度分析:使用SDS-PAGE和高效液相色谱(HPLC)评估
3.效价测定:通过ELISA法确定抗体工作稀释度
4.特异性验证:采用Western blot、免疫组化或免疫荧光等方法
5.亲和力评估:通过表面等离子共振(SPR)或ELISA法测定
▌质量控制与标准化
为确保抗体批次间一致性,需要建立严格的质量控制体系。这包括使用标准化的免疫程序、统一的检测方法和明确的验收标准。关键质量控制参数包括:抗体浓度(通常不低于1mg/mL)、纯度(通常SDS-PAGE显示主要条带纯度≥90%)、效价(ELISA效价不低于1:32,000)以及功能验证(在预定应用中表现一致)。
对于长期保存,纯化抗体建议添加50%甘油或稳定剂,于-20℃保存;或分装后于-80℃长期保存。避免反复冻融,一般建议分装成小体积使用。
▌应用注意事项
兔多克隆抗体在应用中需注意以下技术要点:
首先,不同批次抗体可能存在差异,建议一次性购买足够用量;
其次,应用前需通过预实验确定最佳稀释度;
第三,注意种属交叉反应性,特别是当检测样本来自与兔亲缘关系较近的物种时;
第四,对于磷酸化抗体等翻译后修饰特异性抗体,需注意保存条件和使用缓冲液成分,防止修饰基团丢失。